FDA認(rèn)證需要多少錢?一份關(guān)于成本、流程與實(shí)戰(zhàn)策略的完全指南
FDA認(rèn)證需要多少錢?一份關(guān)于成本、流程與實(shí)戰(zhàn)策略的完全指南
“做FDA認(rèn)證要花多少錢?”這是所有計(jì)劃進(jìn)入美國市場的食品、醫(yī)療器械、藥品和化妝品企業(yè)首先面臨的現(xiàn)實(shí)問題。與歐盟CE認(rèn)證不同,美國食品藥品監(jiān)督管理局(FDA)的準(zhǔn)入體系更為復(fù)雜多樣,其成本跨度可以從數(shù)千美元到數(shù)百萬美元。本文將為您系統(tǒng)拆解FDA認(rèn)證的核心流程,并提供一份基于市場現(xiàn)狀的詳細(xì)成本分析,幫助企業(yè)精準(zhǔn)預(yù)測和管控這項(xiàng)關(guān)鍵投資。
一、FDA認(rèn)證總覽:它不是“一個(gè)認(rèn)證”,而是一套體系
首先必須建立核心認(rèn)知:FDA沒有名為“FDA認(rèn)證”的單一證書。所謂的“FDA認(rèn)證”,通常指產(chǎn)品成功完成FDA法規(guī)要求的某一特定注冊(cè)、備案或?qū)徟鞒蹋瑥亩@得進(jìn)入美國市場的合法資格。其路徑和成本完全取決于產(chǎn)品類別和風(fēng)險(xiǎn)等級(jí)。
下圖清晰展示了如何根據(jù)產(chǎn)品類型確定對(duì)應(yīng)的FDA監(jiān)管路徑與核心要求,這是理解后續(xù)所有流程和成本的基礎(chǔ):
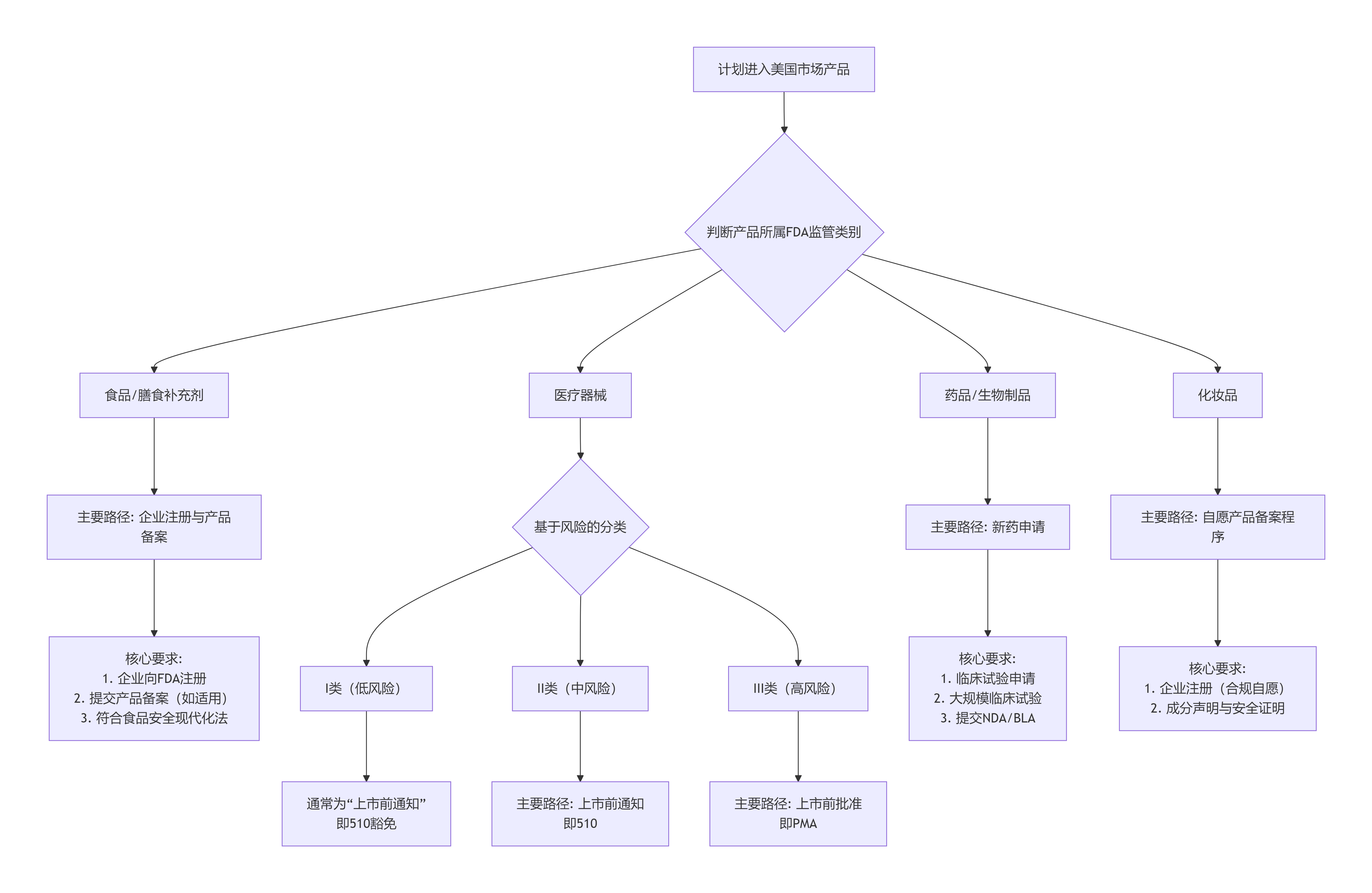 如圖,不同產(chǎn)品的準(zhǔn)入“門檻”天差地別,這也直接決定了成本的巨大差異。
如圖,不同產(chǎn)品的準(zhǔn)入“門檻”天差地別,這也直接決定了成本的巨大差異。二、分步詳解:主要類別產(chǎn)品的合規(guī)核心路徑
下表以醫(yī)療器械、食品、藥品和化妝品為例,詳細(xì)說明了其核心的FDA合規(guī)路徑及關(guān)鍵任務(wù)。
| 產(chǎn)品類別 | 主要監(jiān)管路徑 | 核心任務(wù)與要求 | 負(fù)責(zé)的FDA中心 |
|---|---|---|---|
| 醫(yī)療器械 | 510(k)(上市前通知):證明新產(chǎn)品與已合法上市的“實(shí)質(zhì)等同”產(chǎn)品同樣安全有效。 PMA(上市前批準(zhǔn)):適用于高風(fēng)險(xiǎn)III類器械,需提供嚴(yán)格的科學(xué)證據(jù)(通常包括臨床試驗(yàn))。 De Novo:針對(duì)新型中低風(fēng)險(xiǎn)器械的分類請(qǐng)求。 | 1. 完成產(chǎn)品分類(I, II, III類)。 2. 建立符合質(zhì)量體系法規(guī)的生產(chǎn)體系。 3. 準(zhǔn)備詳盡的技術(shù)文檔。 4. 提交申請(qǐng)并應(yīng)對(duì)FDA問詢。 5. 完成企業(yè)注冊(cè)與產(chǎn)品列名。 | CDRH (器械與放射健康中心) |
| 食品/膳食補(bǔ)充劑 | 企業(yè)注冊(cè):所有涉及生產(chǎn)、加工、包裝、儲(chǔ)存的美國國內(nèi)外企業(yè)必須向FDA注冊(cè)。 產(chǎn)品備案:適用于酸化和低酸罐頭食品等。 符合FSMA:需建立預(yù)防性控制措施。 | 1. 每偶數(shù)年更新企業(yè)注冊(cè)。 2. 確保標(biāo)簽符合營養(yǎng)成分標(biāo)簽法規(guī)。 3. 建立食品安全計(jì)劃。 4. 應(yīng)對(duì)可能的現(xiàn)場檢查。 | CFSAN (食品安全與應(yīng)用營養(yǎng)中心) |
| 藥品/生物制品 | NDA(新藥申請(qǐng))/BLA(生物制品許可申請(qǐng)):需經(jīng)過嚴(yán)格的臨床試驗(yàn)階段證明安全性與有效性。 | 1. 臨床前研究。 2. 提交IND(臨床試驗(yàn)申請(qǐng))。 3. 進(jìn)行I、II、III期臨床試驗(yàn)。 4. 提交NDA/BLA,包含全部數(shù)據(jù)。 5. 建立cGMP合規(guī)生產(chǎn)體系。 | CDER/CBER (藥物/生物制品評(píng)價(jià)與研究中心) |
| 化妝品 | VCRP(自愿化妝品注冊(cè)計(jì)劃):企業(yè)注冊(cè)和產(chǎn)品備案均為自愿,但強(qiáng)烈建議。 符合MoCRA法規(guī):2023年新法,將引入強(qiáng)制企業(yè)注冊(cè)、產(chǎn)品列名、安全證明等要求。 | 1. 確保成分安全,標(biāo)簽合規(guī)。 2. 自愿完成工廠注冊(cè)與產(chǎn)品成分聲明。 3. 為即將到來的MoCRA強(qiáng)制要求做準(zhǔn)備。 | CFSAN |
三、費(fèi)用深度剖析:成本構(gòu)成與市場參考
FDA相關(guān)費(fèi)用主要由官方申請(qǐng)費(fèi)和第三方服務(wù)費(fèi)兩大部分構(gòu)成。下表提供了截至2024財(cái)年(2023年10月1日起)的詳細(xì)費(fèi)用參考。
| 費(fèi)用大項(xiàng) | 具體分項(xiàng)與說明 | 市場參考價(jià)格范圍(美元) | 主要影響因素與備注 |
|---|---|---|---|
| 1. FDA官方申請(qǐng)費(fèi) | 510(k)提交費(fèi):標(biāo)準(zhǔn)企業(yè)需繳納的審核費(fèi)。 | $21,760 | 費(fèi)用每年調(diào)整。小型企業(yè)可申請(qǐng)大幅減免(通常為標(biāo)準(zhǔn)費(fèi)用的30%-50%),需提交資質(zhì)證明。 |
| PMA申請(qǐng)費(fèi):標(biāo)準(zhǔn)企業(yè)提交PMA的費(fèi)用。 | $483,560 | 小型企業(yè)減免后約為$121,760。這是單次申請(qǐng)的費(fèi)用,不含后續(xù)補(bǔ)充。 | |
| De Novo請(qǐng)求費(fèi) | $147,546 | 小型企業(yè)減免后約為$36,937。 | |
| 藥品NDA/BLA申請(qǐng)費(fèi) | 超過$300萬美元 | 按需評(píng)審的“處方藥用戶費(fèi)用法案”費(fèi)用計(jì)算,極其昂貴。 | |
| 企業(yè)注冊(cè)與列名費(fèi) | 免費(fèi) | 食品、醫(yī)療器械、化妝品的企業(yè)注冊(cè)和產(chǎn)品列名本身不收費(fèi)。 | |
| 2. 第三方專業(yè)服務(wù)費(fèi) | 法規(guī)咨詢與項(xiàng)目管理費(fèi) | $15,000 - $100,000+ | 產(chǎn)品復(fù)雜程度、咨詢公司經(jīng)驗(yàn)、服務(wù)范圍(是否包含全程文件撰寫、模擬審核等)。 |
| 技術(shù)文件/申報(bào)資料編寫費(fèi) | 510(k):$20,000 - $80,000 PMA:$250,000 - $1,000,000+ | 這是最主要的變量之一。費(fèi)用取決于所需測試數(shù)據(jù)的多少、文獻(xiàn)檢索的難度、與對(duì)比器械分析的復(fù)雜性。 | |
| 合規(guī)測試費(fèi) | $10,000 - $500,000+ | 這是最大的不確定成本。包括: - 生物相容性測試:$5,000 - $50,000 - 滅菌驗(yàn)證:$10,000 - $30,000 - 軟件驗(yàn)證:$10,000 - $100,000+ - 性能/臨床測試:費(fèi)用極高,取決于樣本量和周期。 | |
| 質(zhì)量管理體系建立與審計(jì)費(fèi) | $20,000 - $100,000+ | 建立符合FDA 21 CFR Part 820(QSR)或藥品cGMP的體系,包括文件系統(tǒng)、人員培訓(xùn)、內(nèi)部審計(jì)等。首次FDA工廠檢查前的模擬審計(jì)至關(guān)重要。 | |
| 臨床試驗(yàn)費(fèi)(如需要) | $50萬 - 數(shù)億美元 | 僅適用于PMA器械和藥品。是藥物開發(fā)中占比最高的成本,取決于試驗(yàn)階段、規(guī)模、疾病領(lǐng)域和地域。 |
費(fèi)用估算參考(以醫(yī)療器械為例,不含臨床試驗(yàn))
I類器械(大部分為510(k)豁免):以企業(yè)注冊(cè)、列名和體系合規(guī)為主。總成本主要在2萬 - 8萬美元,主要用于咨詢和體系建立。
II類器械(標(biāo)準(zhǔn)510(k)路徑):這是最常見的情況。總成本通常在 8萬 - 25萬美元 之間。其中官方申請(qǐng)費(fèi)約2.2萬,其余為測試、文件編寫和咨詢服務(wù)費(fèi)。
III類器械(PMA路徑):成本高昂且周期長。僅準(zhǔn)備和提交PMA申請(qǐng)的費(fèi)用就可能超過 100萬 - 300萬美元。若需要從頭開展臨床試驗(yàn),總投入可達(dá)數(shù)千萬甚至上億美元。
四、關(guān)鍵建議:如何規(guī)劃與控制您的FDA合規(guī)成本
精準(zhǔn)分類是成本控制的起點(diǎn):在產(chǎn)品研發(fā)初期就投入資源,與法規(guī)專家共同明確產(chǎn)品分類和預(yù)期申報(bào)路徑。一個(gè)分類上的偏差可能導(dǎo)致后續(xù)數(shù)百萬美元的額外支出。
將“合規(guī)性設(shè)計(jì)”融入研發(fā):在設(shè)計(jì)和開發(fā)階段就全面考慮FDA的法規(guī)要求(如設(shè)計(jì)控制、風(fēng)險(xiǎn)分析、測試標(biāo)準(zhǔn)),能最大程度避免后期的設(shè)計(jì)變更和重復(fù)測試,這是最有效的成本控制方法。
善用“小企業(yè)資質(zhì)”減免官方費(fèi)用:符合條件的美國本土或海外企業(yè)(總收入低于1億美元)均可申請(qǐng),能大幅降低官方申請(qǐng)費(fèi)。
選擇有成功經(jīng)驗(yàn)的合作伙伴:專業(yè)的法規(guī)顧問和測試實(shí)驗(yàn)室雖然前期收費(fèi)可能較高,但其高效準(zhǔn)確的指導(dǎo)能避免因申報(bào)失敗、反復(fù)補(bǔ)充資料導(dǎo)致的巨額時(shí)間與金錢浪費(fèi)。
預(yù)算中必須包含“應(yīng)急儲(chǔ)備”:FDA審核過程中提出額外問題或要求補(bǔ)充數(shù)據(jù)是常態(tài),項(xiàng)目預(yù)算應(yīng)預(yù)留至少20%-30%的彈性空間以應(yīng)對(duì)不確定性。
總結(jié)而言,F(xiàn)DA準(zhǔn)入是一項(xiàng)戰(zhàn)略投資,而非簡單支出。 其費(fèi)用本質(zhì)上是為證明產(chǎn)品在美國監(jiān)管框架下的安全性與有效性所必須投入的科學(xué)、工程和法規(guī)資源的總和。理性規(guī)劃、盡早介入、選擇正確的路徑和合作伙伴,不僅能管理好成本,更能為企業(yè)奠定在美國市場長期成功的基礎(chǔ)。
熱門文章
-
FDA認(rèn)證需要多少錢?一份關(guān)于成本、流程與實(shí)戰(zhàn)策略的完全指南
2025年12月19日
-
e-mark認(rèn)證全解析:汽車零部件出口歐洲的強(qiáng)制性通行證與成本指南
2025年12月19日
-
ECE R160事件數(shù)據(jù)記錄器(EDR)E-mark認(rèn)證解讀
2025年12月17日
-
ECE R 105法規(guī)E-mark認(rèn)證
2025年12月11日
-
emark認(rèn)證(e-mark認(rèn)證)
2025年12月8日
-
EN 15129-減隔震CE認(rèn)證
2025年12月7日
-
鋼結(jié)構(gòu)申請(qǐng)澳大利亞 SCA 認(rèn)證(Steel Compliance Australia)全流程指南
2025年12月7日
-
美國焊接協(xié)會(huì)AWS認(rèn)證-AWS焊接人員認(rèn)可-AWS焊接工藝評(píng)定
2025年12月4日
-
美國鋼結(jié)構(gòu)協(xié)會(huì)AISC認(rèn)證
2025年12月4日
-
澳洲鋼結(jié)構(gòu)SCA認(rèn)證
2025年12月4日

 獲取更多資訊
獲取更多資訊
